In der letzten Zeit spielen minimal-invasive Resektionen und
Robotik-Verfahren eine zunehmende Rolle in der Chirurgie des Magenkarzinoms.
Dabei stellt sich die Frage, ob die neuen Techniken (I) onkologisch adäquat sind
(gemessen an der Anzahl der resezierten Lymphknoten bzw. der Lymphknoten-Ratio
und der Rate an R0-Resektionen), und inwiefern sich (II) die postoperative
Morbidität und Letalität bzw. (III) das Langzeitüberleben im Vergleich zum
konventionell-offenen Vorgehen verhält. Dabei zeigte die Analyse von Son et al.
zur minimal-invasiven vs. offenen subtotalen Magenresektion beim Karzinom, dass
die OP-Dauer beim offenen Vorgehen kürzer und die Anzahl der resezierten
Lymphknoten größer, hingegen der intraoperative Blutverlust höher war als bei
der minimal-invasiven Resektion.
Morbidität und Letalität unterschieden sich postoperativ nicht signifikant
voneinander. Die Metaanalyse von Zou et al. erbrachte keine Unterschiede des
Gesamt- und krankheitsfreien 5 Jahres-Überlebens nach laparoskopischer vs.
offener D2-Gastrektomie beim lokal fortgeschrittenen Magenkarzinom.
Hingegen konnten Lin et al. in einer Case Control-Studie bei 2041
konsekutiven laparoskopischen Gastrektomien einen signifikanten
Überlebensvorteil zugunsten des minimal-invasiven Verfahrens nach 3 Jahren
feststellen, wobei sich bei Letzterem Patienten mit initial günstigeren
Tumorstadien fanden. Morbidität und Letalität waren in beiden Gruppen
vergleichbar.
Da letztlich die Langzeitresultate der minimal-invasiven Gastrektomie unklar
sind, rekrutieren derzeit 3 große asiatische multizentrische,
prospektiv-randomisierte, kontrollierte Studien zur laparoskopischen
Gastrektomie beim fortgeschrittenen Magenkarzinom mit insgesamt > 2600
geplanten Patienten: die Korean Laparoscopic Gastrointestinal Surgery
Study (KLASS 02) (Phase III-Studie), die Japanese Laparoscopic Gastric
Surgery Study (JLSSG 0901) (Phase II / III-Studie) und die Chinese
Laparoscopic Gastrointestinal Surgery Study (CLASS 01) (Phase III-Studie).
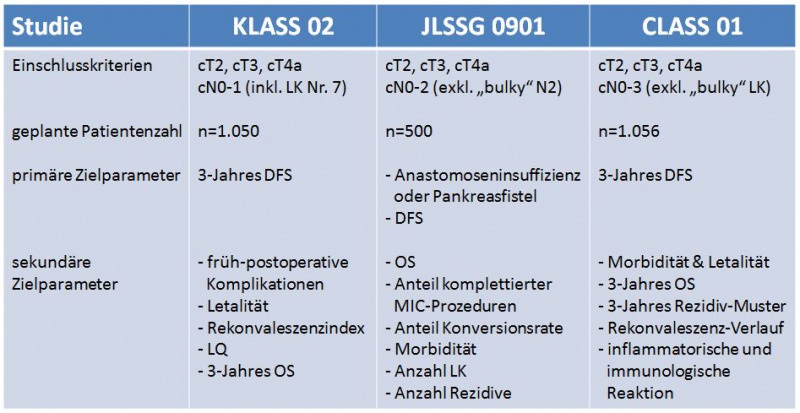
Multizentrische, prospektiv-randomisierte, kontrollierte Studien zur laparoskopischen Gastrektomie beim fortgeschrittenen Magenkarzinom; Quelle: Ines Gockel
Ob die zukünftigen Resultate auf europäische Patienten übertragbar sein
werden, ist aufgrund unterschiedlicher Konstitutionen (niedrigerer Body Mass
Index) sowie differenter multimodaler Konzepte unklar.
Die Robotik D2-Gastrektomie bietet den Vorteil einer potentiell besseren
Visualisierung und präziseren Dissektion von Lymphknoten. So konstatierten Baek
et al. in ihrer Übersichtsarbeit, dass die Respektierung onkologischer Prinzipien
gewährleistet sei mit durchschnittlichen Lymphknotenzahlen, die deutlich über
der in der deutschen Leitlinie geforderten Mindestzahl von n=25 Lymphknoten
lagen. Ob dies auch mit einem verbesserten Langzeitüberleben assoziiert
ist, ist derzeit nicht geklärt.
Die Effizienz der 3 unterschiedlichen Zugangswege (Robotik vs.
minimal-invasiv vs. konventionell-offen) wurde in einer Metaanalyse von Zong et
al. untersucht (12 Studien mit 8493 Patienten). Hier waren der Blutverlust
beim Robotik- und laparoskopischen Verfahren signifikant geringer als beim
offenen, die OP-Dauer mit dem OP-Roboter längsten. Sowohl die Anzahl der
entfernten Lymphknoten als auch die postoperative Morbidität und Letalität
unterschieden sich bei allen 3 Methoden nicht signifikant voneinander.
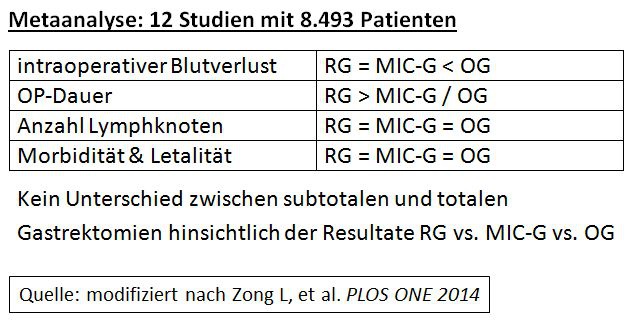
Vergleich der Effektivität zwischen Robotik (RG) vs. MIC (MIC-G) vs.
offener (OG) Gastrektmoie beim Magenkarzinom
