Das allergische Asthma ist eine komplexe chronische Erkrankung, die durch eine pulmonale Entzündung und eine reversible Obstruktion der Atemwege charakterisiert ist. Ursache ist eine inadäquate Immunreaktion auf an sich harmlose Allergene wie z.B. Pollen oder Hausstaub. Die Inzidenz und Prävalenz des allergischen Asthmas hat sich in den westlichen Industriestaaten innerhalb der letzten zwei Jahrzehnte nahezu verdoppelt. Weltweit leiden ca. 300 Millionen Menschen an Asthma, das zudem in diesen Nationen die häufigste chronische Erkrankung im Kindesalter darstellt. Das allergische Asthma resultiert aus einer gestörten T-helfer 2 (Th2) Zell-vermittelten Entzündungsreaktion in der Lunge, in deren Folge u.a. eosinophile Granulozyten in den Atemwegen akkumulieren.
CD97/ADGRE5 ist ein Adhäsions-G-Protein gekoppelter Rezeptor (ADGR), der im Menschen und in der Maus am stärksten in Immunzellen und in der Lunge exprimiert wird. Wir sehen in Asthmamodellen der Maus, dass ein Verlust von Cd97 (Cd97-/-) zu einer deutlichen Verschlechterung des Asthmas führt und klären zur Zeit die zugrundliegenden (Immun)Mechanismen. Eine CD97-abhängige Aktivierung von naiven CD4+ T-Zellen und eine Induktion von regulatorischen T-Zellen könnten bei der Entstehung oder Ausprägung der Th2-Zell-vermittelten Entzündungsreaktion eine wichtige Rolle spielen.
Das Projekt wird in enger Kooperation mit der Arbeitsgruppe von PD Tobias Polte (Department Umweltimmunologie, Helmholtz-Zentrum für Umweltforschung, UFZ Leipzig) realisiert.
Gefördert durch die Deutsche Forschungsgemeinschaft (AU132/10-1)
![]()
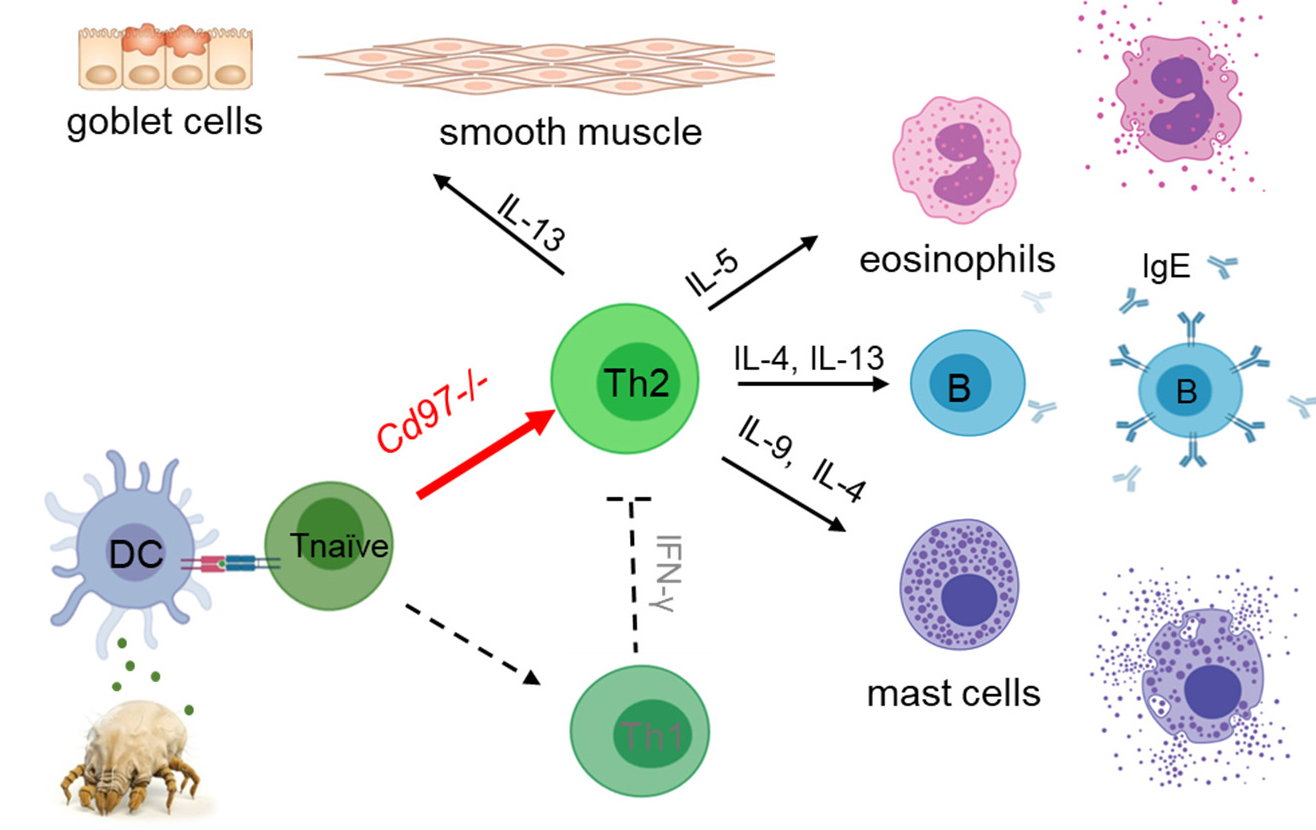
Abb. Immunmechanismen, die zur Entstehung des allergischen Asthmas beitragen. Der Verlust von CD97 verstärkt die zugrundeliegende Th2-gewichtete Immunantwort. Mäuse ohne diesen Rezeptor erkranken schwerer an Asthma.
