Die Achalasie gehört zu denjenigen Erkrankungen, deren Entstehungsmechanismen auch bis zum heutigen Zeitpunkt noch nicht hinreichend geklärt ist. Es wird vermutet, dass es nach einem initialen Insult, möglicherweise einem viralen Infekt, zu einer Entzündung des Plexus myentericus der Speiseröhre kommt, welche - bei Patienten mit einer genetischen Prädisposition - durch anti-myenterische Antikörper in einer Zerstörung der Nervenzellen und somit im Vollbild der Achalasie resultiert.
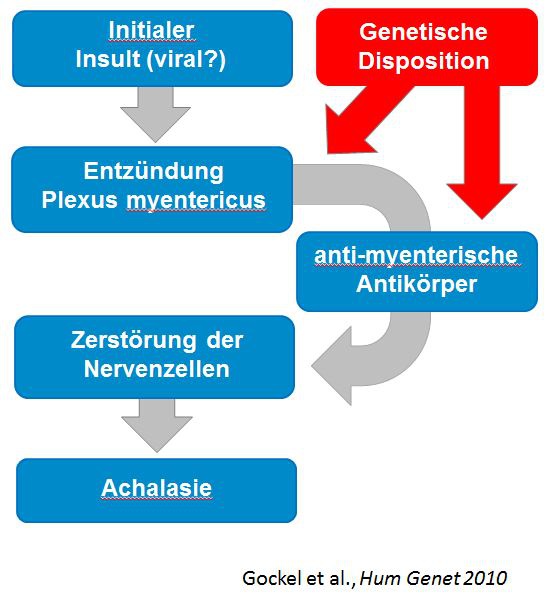 | Entstehungsmechanismus der Achalasie |
Als Erreger wurden Varizella Zoster-Viren, Masernviren und humane Papillomaviren diskutiert. Diese Theorie konnte aber nie anhand einer größeren Kohorte Erkrankter gesichert werden. Abzugrenzen hiervon ist die Chagas-Krankheit, übertragen durch Trypanosoma cruzi, welche überwiegend in Süd- und Mittelamerika vorkommt, deren phänotypisches Bild mit einem Megaösophagus allerdings nicht von der idiopathischen Achalasie zu unterscheiden ist. Die Autoimmungenese bei Patienten mit genetischer Disposition wird durch die Tatsache gestützt, dass sich bei der Zerstörung der Nervenzellen CD3+ / CD8+ zytotoxische T-Lymphozyten mit dem Oberflächenantigen HLA-DQw1 finden. Im bisher weltweit größten Kollektiv von 1.068 Achalasiepatienten und 4.242 Kontrollen konnten in der ersten systematischen Assoziationsstudie signifikante Risikovarianten im Bereich der MHC (= Major Histocompatibility Complex)-Region auf Chromosom 6 nachweisen.
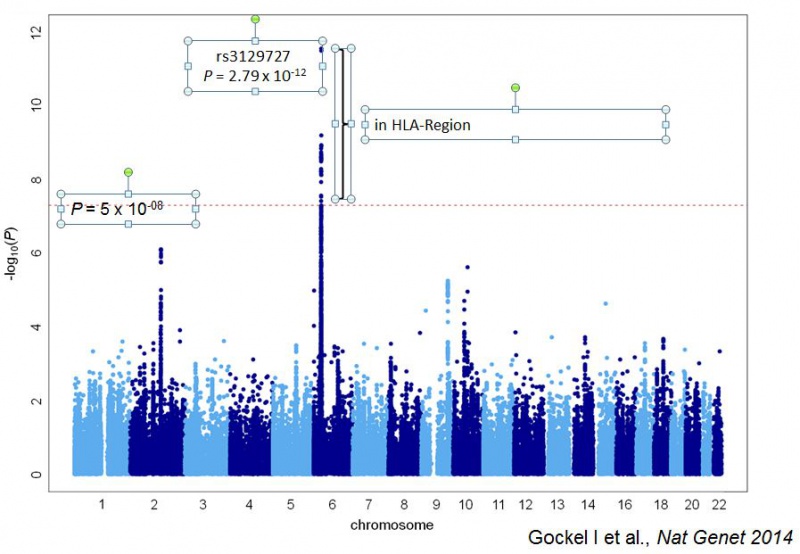 | Manhattan-Plot, GWAS (= Genomwide Association Study) |
Es ist bekannt, dass diese eine der komplexesten Regionen des menschlichen
Genoms darstellt. Die Ergebnisse dieser Studie unterstreichen die Tatsache, dass
genetisch vermittelte Autoimmunprozesse bei der Entstehung der Achalasie eine
Rolle spielen. Die funktionellen Konsequenzen der Risikovarianten,
möglicherweise eine veränderte Antigenpräsentation im Bereich des
Peptid-bindenden Areals des HLA-DQ-Heterodimers, sind derzeit noch hypothetisch
und Gegenstand weiterer Forschungsprojekte. Zudem konnten bei Patienten mit
Achalasie weitere Autoimmunerkrankungen detektiert werden und anti-neuronale
Antikörper fanden sich signifikant häufiger als bei gesunden Kontrollen (bis zu
25,7 Prozent versus 4,4 Prozent; P > 0,0001). Neben der Zerstörung der Nervenzellen im
Rahmen der Pathogenese der Achalasie scheint auch eine Erkrankung bzw. der
Funktionsverlust der glatten Muskelzellen der Speiseröhre im Sinne einer
viszeralen Myopathie eine Rolle zu spielen.
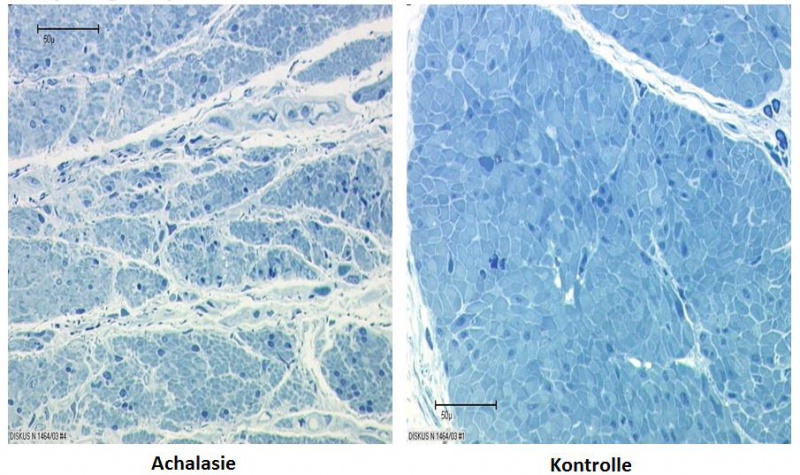 | Viszerale Myopathie der glatten Muskulatur: Richardson-Färbung von Muskelstreifen des unteren Ösophagussphincters |
Die interstitiellen Cajal-Zellen (ICC) - als „Schrittmacherzellen" und Verbindungsglieder zwischen Nerven- und glatter Muskelzelle liegend - sind bei der Achalasie auch reduziert. Die Ursachen dieser Veränderungen des ICC-Netzwerks, die zum ENS (= enterischen Nervensystem) gehören, sind dabei völlig unklar. Bei einem geringen Anteil an Achalasie-Patienten liegt eindeutig eine genetische Ursache vor: beim Allgrove- bzw. Triple A-Syndrom.
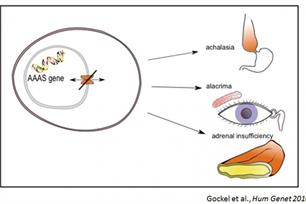 | Genetische Ursachen der Achalasie: Triple-A-Syndrom |
Hierbei handelt es sich um die Syntropie von Achalasie, Alakrimie (= Unfähigkeit zur Tränenproduktion) und adrenocorticotroper (= ACTH-resistenter) adrenaler Insuffizienz (= Nebenniereninsuffizienz), welche autosomal-rezessiv vererbt wird mit Mutationen im AAAS-Gen auf Chromosom 12q13. Eine Achalasie findet sich zu ca. 75 Prozent bei Patienten mit Allgrove-Syndrom und manifestiert sich häufig bereits in der Kindheit. Desweiteren können maligne Tumore des distalen Ösophaus bzw. des ösophago-gastralen Übergangs mit stenosierendem Wachstum zum klinischen und radiologischen Bild einer Achalasie führen. Jedoch handelt es sich dann nicht um eine idiopathische, sondern um eine sekundäre bzw. Pseudo-Achalasie, welche obligat eine endoskopische Untersuchung mit histologischer Sicherung erfordert. Ein Achalasie-ähnliches Krankheitsbild kann darüber hinaus durch Stoffwechselerkrankungen (Speicherkrankheiten), entzündliche Prozesse des Magen-Darm-Trakts, Nerventumore sowie durch Erkrankungen hervorgerufen werden, die zur Zerstörung der glatten Muskulatur oder der Nervenzellen im Auerbach-Plexus der Speiseröhre führen.
Die Ursachen und Entstehungsmechanismen der Achalasie sind aber lange noch nicht geklärt. Die genomweite Assoziationsstudie (GWAS) wird kontinuierlich von uns in Kooperation mit unserem Forschungsnetzwerk ARC (= Achalasia Risk Consortium) fortgesetzt. Das Studienzentrum befindet sich in Leipzig. Je mehr Betroffene teilnehmen, desto größer ist die Wahrscheinlichkeit, viele weitere Genloci zu detektieren bzw. Risikovarianten für die Achalasie zu identifizieren. Diese sollen umfassend mit den klinischen, epidemiologischen und phänotypischen Daten korreliert werden.
Sehr gerne können auch Sie an unserer Studie teilnehmen und ganz wesentlich dazu beitragen, die Ursachen der Achalasie näher zu erforschen. Voraussetzung ist das Vorliegen einer gesicherten, primären Achalasie mittels Manometrie, Röntgen-Breischluck und Endoskopie. Für die Teilnahme ist lediglich eine kleine Blutprobe erforderlich. Weitere Informationen finden Sie auf unserer Webpage.
Bitte kontaktieren Sie uns bei weiteren Fragen auch gerne über unser Leipziger Studienbüro:
Nicole Kreuser
E-Mail: achalasie@medizin.uni-leipzig.de
Telefon: 0341 - 97 12590
