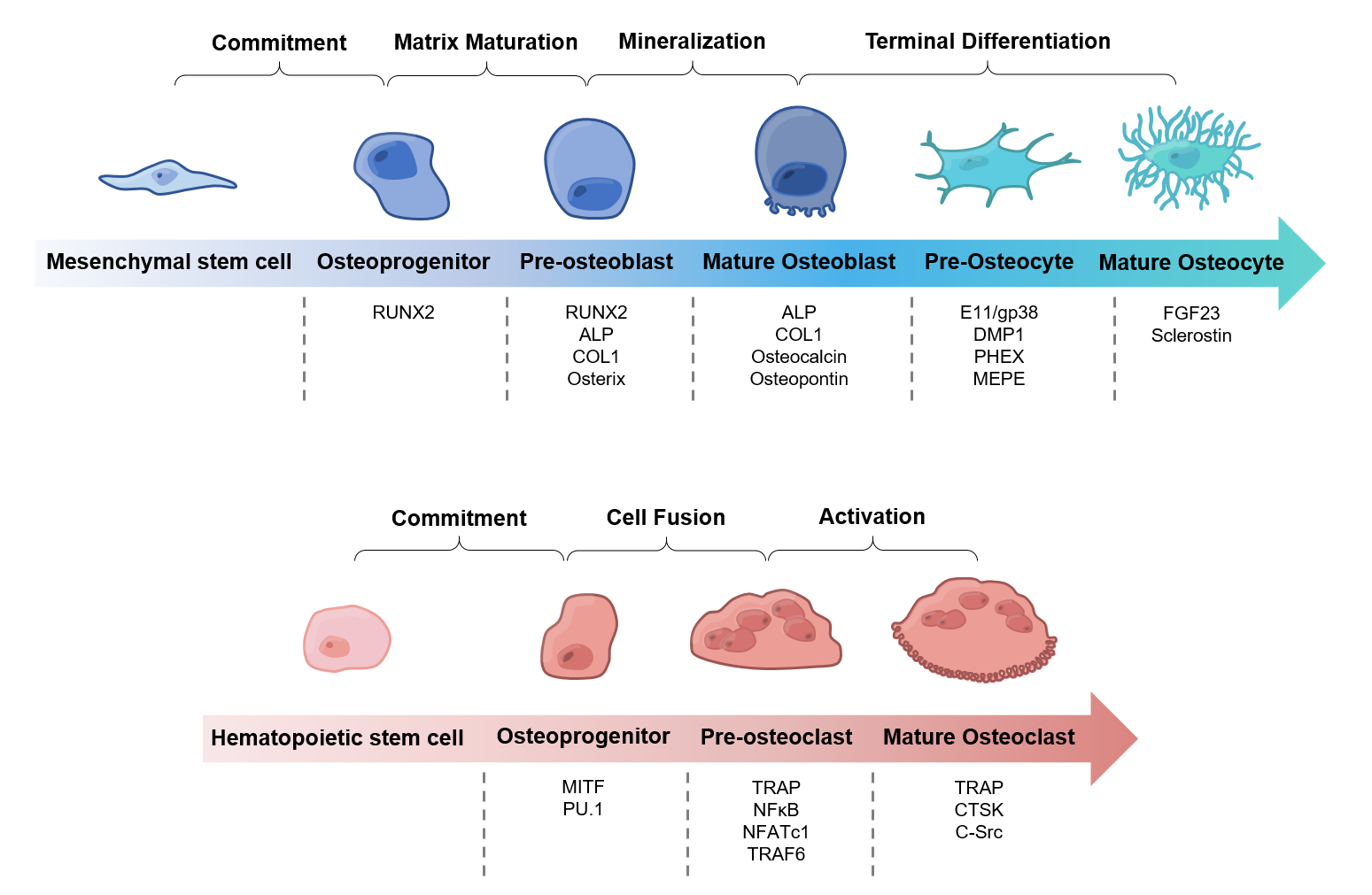
Validierung des Repertoires und der funktionellen Relevanz von aGPCR in Osteoblasten Osteoklasten und Osteozyten
Obwohl mehrere aGPCR mit Knochenerkrankungen oder -funktionsstörungen in Verbindung gebracht wurden, bleibt unklar, welche dieser Rezeptoren an der Regulierung der Knochenhomöostase beteiligt sind. Durch die Analyse des Expressionsmusters aller aGPCR während der Differenzierung von Osteoblasten, Osteoklasten und Osteozyten, konnten wir bereits ein paar vielversprechende Kandidaten identifizieren. Mit Hilfe eines rezeptorspezifischen knockdowns und der Stimulierung des jeweiligen aGPCR mit seinem agonistische Peptid, wollen wir den Beitrag einzelner aGPCR für die Differenzierung und Funktion der Knochenzellen näher untersuchen und herausfinden, welche Signale von dem jeweiligen Rezeptor vermittelt werden.
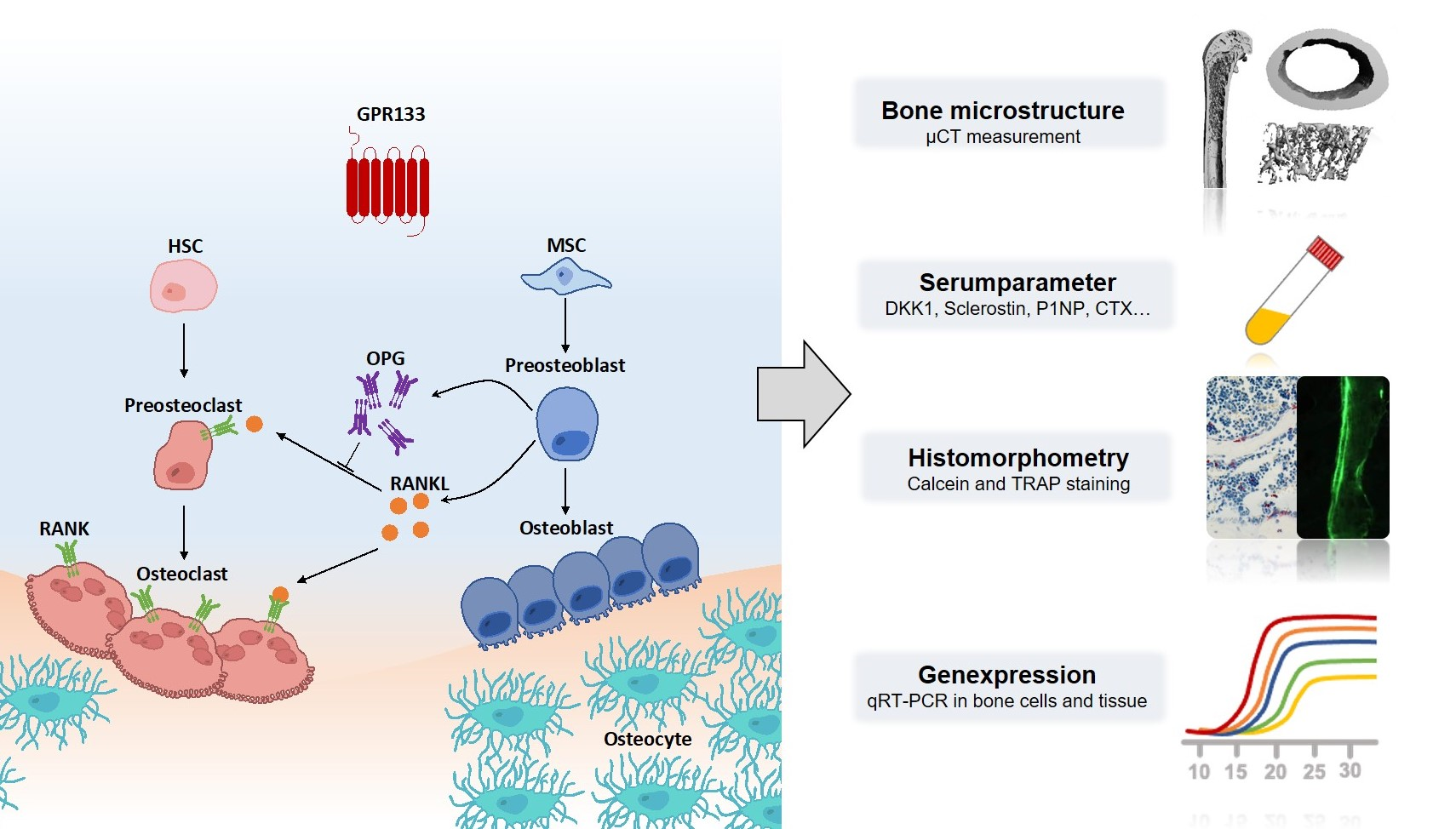
Phänotypische Relevanz von GPR133 bei der Differenzierung von Osteoblasten und Osteoklasten unter Verwendung eines rezeptordefizienten Mausmodells
Erste Untersuchungen zeigten bereits, das Gpr133-KO-Mäuse eine verringerte Knochenmasse aufweisen. Bis jetzt ist jedoch unklar, ob dieser Phänotyp von einer verringerten Knochenformation oder einer erhöhten Knochenresorption herrührt. Um dieser Frage auf den Grund zu gehen werden die Knochen der Tiere detaillierter untersucht. So wird unter anderem die Mikroarchitektur mittels µCT untersucht und deren zelluläre Beschaffenheit mittels histologischer Methoden analysiert. Zusätzlich erfolgt die Untersuchung verschiedener Serumparameter.
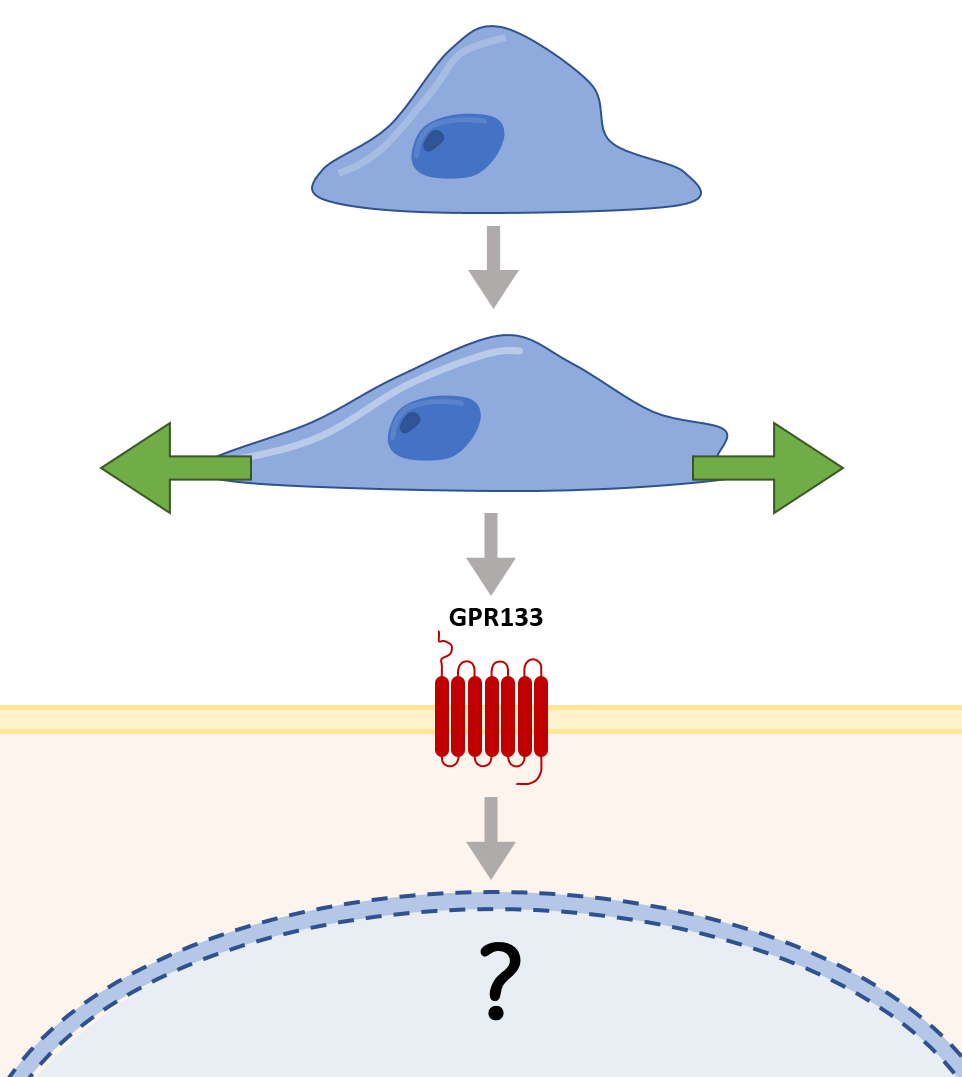
Etablierung eines In-vitro-Stretching-Modells für Osteoblasten und Osteozyten, um die Rolle von GPR133 als metabotroper Mechanosensor zu untersuchen
Es wurde gezeigt, dass mechanische Belastung die Differenzierung von Osteoblasten fördert, während sie die Differenzierung in Adipozyten behindert. Die Dauer und Intensität des mechanischen Reizes spielt dabei eine entscheidende Rolle und beeinflusst die Aktivierung bzw. Inhibierung verschiedener Signalwege, welche bei dem Differenzierungsprozess beteiligt sind. Auch wenn bereits mehrerer aGPCR als potenzielle Mechanorezeptoren identifiziert wurden fokussieren wir uns zunächst auf den GPR133. Hierfür wurde bereits ein in vitro-Stretching-Modell mit primären Zellen in unserem Labor entwickelt. Mit Hilfe weiterführende Experimente wollen wir die Relevanz von GPR133 als Mechanorezeptor in Osteoblasten bzw. Osteozyten erforschen.