Mouse models and primary cell culture are common models in the field of tumor research and build the foundation for clinical therapy. The results gained by those methods are however poorly adaptable to the human organism due to inter-species differences and intercellular mechanisms. Further, the high impact of heterogeneity, immunology and stroma associated modulations in tumor biology require new strategies to investigate complex tissue equilibration. Organotypic slice cultures of human cancers are suitable to obtain an enhanced understanding of certain inter-cellular processes and thus can reduce the translational steps from cellular and mouse-based research towards clinical implementation.
The focus of this BMBF-funded project relies on the investigation of tumor-related mechanisms of resistance and to build up a patient-oriented tool to predict susceptibility for certain therapies.
PROJECT 1
Organotypic slice cultures of human cancers of the GI tract
In cooperation with Prof. Florian Lordick, MD Justus Körfer, MD Sebastian Pill, MD Laura Hennig and MD Rasmus Sönnichsen
Poor prognosis and high biologic heterogeneity are main characteristics of colon and gastric cancer. The high rate of patients that do not respond to cytotoxic treatment urge for predictive assays for the individual patient. We aim to standardize the organotypic tumour slice culture system to investigate cytotoxic drug susceptibility prior to patient treatment, which may lead to personalised and more precise treatment strategies.
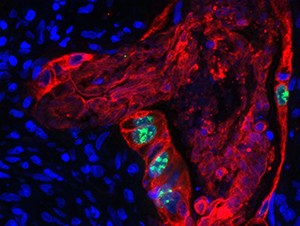
Figure 1: Colon Cancer AE1 3 (red) Ki67 (green) DAPI Blue 40x
PROJECT 2
Organotypic slice cultures of human lung cancer
In cooperation with Dr. Sebastian Krämer, Prof. Florian Lordick, Prof. Uwe Eichfeld, MD David Junk
Lung cancer belongs to the most malignant tumor entities and although therapeutic advances could be made in surgery techniques and cytostatic treatments, the prognosis remains poor. Novel therapies, targeting the immune system, promise beneficial effects. Still, there are predictive assays needed that prevent ineffective treatment, as not all patients respond equally to applied therapies. A standardized organotypic tumor slice culture system offers the opportunity to study the individual tumor towards its susceptibility to different drugs.
The leading hypothesis of this project is that nutrition-induced cerebral accumulation of fatty acids, related bioactive lipids and their metabolites can promote microglial senescence and loss, e.g. by causing vascular stiffness and/or peroxysomal
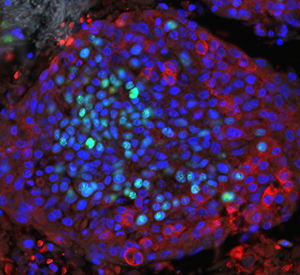
Figure 2: DiV3 20x DAPI (blue) Glut1 (red) Ki67 (green) Lung Cancer
PROJECT 3
Organotypic slice cultures of human glioblastoma multiforme tissue
In cooperation with Prof. Frank Gaunitz and Prof. Jürgen Meixensberger, Dr. Susann Hähnel
Glioblastoma multiforme often and quickly develops resistance towards standard treatment, consisting of chemotherapy and radiation. Organotypic slice cultures of human glioblastoma multiforme tissue can be cultivated and treated with the clinical standard protocol. The project aims to correlate the response of patient-derived slice cultures with the prospective follow up of the corresponding patient. Furthermore, the underlying mechanisms which allow the tumor to escape therapy and to spread even faster into healthy brain tissue are studied by deep sequencing data of patient-derived glioblastoma multiforme tissue.
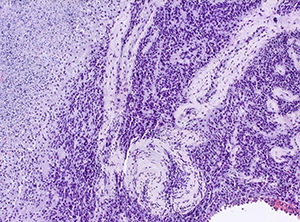
Figure 3: DiV7 10x HE Glioblastoma multiforme
PROJECT 4
Adeno-associated Viral Vector transduction in glioblastoma multiforme
In cooperation with PD. Ulrich Hacker, Prof. Frank Gaunitz, Prof. Jürgen Meixensberger und Prof. Hildegard Büning, MD Jule Ußmann
Glioblastoma multiforme represents the most malignant brain tumor with poor prognosis and high recurrence rates. Recurrence is believed to be induced by stem cell like cancer stem cells which are resistant to standard therapy. Primary neurosphere cultures display the stem cell like tumor cells, providing an exellent setup to investigate resistance mechanisms and novel stategies to combat these tumor-inducing cells. Adeno-associated virus (AAV) vectors have gained an increasing attention as gene therapy vectors for several diseases. The first clinically approved AAV-based gene therapy in the Western world is Glibera® demonstrating that this approach can successfully and safely be applied. The project studies AAV targeting vectors in primary human spheroid cultures and organoid tissue cultures of glioblastoma multiforme tissue.
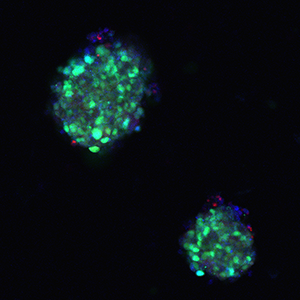 Figure 4: AAV GFP PI (red) Hoechst (blue) 10x
Figure 4: AAV GFP PI (red) Hoechst (blue) 10xPROJECT 5
Methodological Investigation of organotypic slice cultures
In cooperation with Vera Blaschke, master student
Monolayer cell culture models are lacking extracellular cues that can affect cellular phenotype and therewith display different results compared to three-dimensional cell culture. Recent studies have shown that three-dimensional cell and tissue culture are valuable tools for drug testing, cellular investigations but also mean to become beneficial in personalized medicine. Though application of standard methods like PCR, WB or histology is applicable, FACS analysis however needs to be established as tissue dissociation is crucial for cellular expression profiles. FACS analysis is time-saving and allows investigating changes of various cell populations or cellular changes within one tumor sample. The present master thesis aims to define a tissue dissociation protocol well adapted for long term tissue culture. Organotypic tumor slice cultures will be studied for immunological populations such as microglia/macrophages and T-cell populations.